又是一年3.15,又到一年维权时。
作为与生命和健康安全紧密相关的领域,医疗器械任何一个环节都容不得半点瑕疵。
要做好,先要懂。要切实保障医疗器械质量安全,为消费者营造良好的用械环境,推动我市医械企业高质量发展,就要从“读懂”、“读透”相关法规指南开始。
为配合医械企业加强医疗器械经营质量管理体系建设,推进医械企业管理体系和管理能力现代化,实现医械企业管理能力提升,常州医疗器械产业研究院于2023年3月15日下午举办了《医疗器械注册质量管理体系核查指南》专题培训,得到了全市医械同行的广发关注和积极响应。来自武进、钟楼、天宁、新北及常州经开区等区域120余名医械企业代表参加了本次培训交流活动。

本次培训由常州医疗器械产业研究院主办,常州医疗器械创业服务中心、劢迪(常州)医药科技有限公司承办,常州市新天地职业培训学校协办。
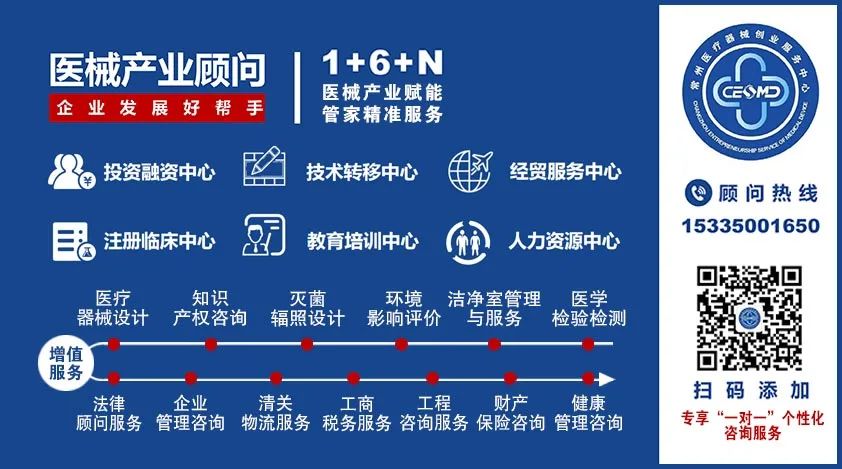
培训开始之前,常州医疗器械产业研究院有限公司副总经理刘国峰重点介绍了研究院“1+6+N”的全生命周期服务。研究院致力于“医械产业服务赋能,产业顾问全程陪跑”,始终确立以科技金融、技术转移、注册临床、教育培训、人力资源、贸易经销作为研究院的六大核心服务项目,不断向医械企业输送价值。同时,刘总对于医械产业顾问和“医械产业管家”小程序的现场介绍,更是体现了研究院坚持“与企业共成长”的服务初心,着力推动产业服务数字化,为医疗器械研发、生产和经营企业提供高质量的专业服务,从而使大家对研究院的服务模式有了更具体更全面的了解。

在培训过程中,拥有20多年医疗器械行业丰富经验的吴老师从指南发布背景、2022版和2020版注册体系核查指南相关差异性出发,结合实际案例进行了全面深入的解读。“从指南中来,到工作中去”的培训方式获得了在场人员的高度认可。


最后的互动交流环节,吴老师“抛砖引玉”提出两个问题,引导企业代表“发现问题,提出问题,解决问题”,在现场引起了广泛讨论。许多企业代表也提出了自身企业目前存在的各种问题,吴老师与其团队逐一进行了详细答复。
Q:
针对4.3.4(注册检验和临床试验产品生产) 应当保留用于注册检验产品和临床试验产品研发、生产的厂房设施与设备以及相关使用记录。如遇不可抗力无法保留的,应当留存可以证明产品研发、生产及验证等产品实现过程活动真实、完整和可追溯的证据资料。如果企业在注册申报过程中,遇到这种情况应该怎么应对?
A:
医疗器械注册申请已受理,若原样品试制场地已经动迁拆除(或其他不可抗拒的因素)不复存续,企业可提交书面情况说明、原场地生产同类产品符合《医疗器械生产质量管理规范》的证明材料、样品生产真实性书面承诺,并在新场地重新生产样品并经过第三方型式检测合格,可在新场地实施注册体系核查工作。
【注:以上特殊情况不包括尚未完成型式检测或临床试验,注册申请尚未受理的企业。】
Q:
某企业走注册人制度,已获得医疗器械产品注册证,受托企业已获得相应范围的生产许可证。如果注册人想要自己生产,新增生产地址,应如何办理相关手续?何时申请体系核查?
A:
先申请生产许可证新开办,申请体系核查,拿到生产许可证后,再办理注册证变更备案,新增生产地址。


用诚信之光照亮消费者信心,用专业之能照亮医械企业信心。“诚”是上天的准则,追求“诚”是为人的准则,所谓“诚者天之道,思诚者人之道”,说得正是这个道理。
但常州医疗器械产业研究院认为,诚不光是“诚信”,更是在诚信的基础上体现并付之于行动的“诚心”:我们始终坚持诚心诚意为医械企业服务,始终坚持“开放包容,创新协同,价值赋能,发展共赢”十六字准则,为医械产业“有质量,有创新,有效用,有价值”而奋斗!
更多培训敬请持续关注“医械创业服务中心”公众号
